Liệu pháp miễn dịch có thể kích hoạt lại các tế bào T để tiêu diệt các tế bào khối u. Mô hình hóa khối u và sự tương tác của tế bào T giải thích tại sao những tế bào khối u lại bị trúng đích cũng như điều này cải thiện những dự đoán về kết quả liệu pháp miễn dịch.
Các tế bào T của hệ thống miễn dịch có một vai trò then chốt trong nhận diện và loại trừ những tế bào gây ra sự nguy hại cho cơ thể như các tế bào bị nhiễm bệnh và tế bào ung thư. Hai bài báo của tác giả Balachandran et al.1 và Łuksza et al.2 đã nhận được sự đồng thuận của nhiều tác giả, hai bài báo này đã đưa ra một bộ khung để đánh giá làm thế bào các khối u có thể được phát hiện một cách hiệu quả bởi tế bào T – một đặc tính của khối u được biết đến như là tính sinh miễn dịch. Các tác giả đã chỉ ra rằng các mô hình của họ sử dụng để cung cấp các điểm có tính sinh miễn dịch trên khối u có thể được sử dụng để chẩn đoán các phản ứng cận lâm sàng đối với một loại liệu pháp ung thư có tên là phong tỏa điểm kiểm soát (checkpoint blockade).
Phần lớn các tế bào trong cơ thể trình diện các phân mảnh peptide được biết đến là kháng nguyên, chúng được trình diện trên bề mặt của tế bào và được tạo ra từ các protein nội bào. Mội peptide bị giới hạn trong một phức hợp có tính đăc hiệu gọi là MHC I (thuộc nhóm HLA I ở người). Tế bào T được biết đến với tên T gây độc (cytotoxic T) trong cơ thể sẽ tìm kiếm những tế bào trình diện kháng nguyên đặc hiệu trình diên các kháng nguyên từ vi sinh vật xâm nhiễm hoặc các tế bào ung thư, những kháng nguyên này được biết với tên neoantigents, chúng xuất hiện như là kết quả của một đột biến (Hình. 1). Nếu thụ thế của tế bào T gây độc (TCR) nhận diện và kết hợp với một kháng nguyên lạ, tế bào T sẽ tấn công tiêu diệt các tế bào trình diện kháng nguyên này. TCR có độ da dạng cao và có các khu vực kết hợp với kháng nguyên khác nhau, cho phép hệ miễn dịch nhận diện hàng triệu kháng nguyên3. Kháng nguyên kết hợp với protein MHC và sự nhận diện của TCR đối với kháng nguyên được trình diện trên phức hợp MHC là nhân tố quyết định đối với mọi đáp ứng miễn dịch.
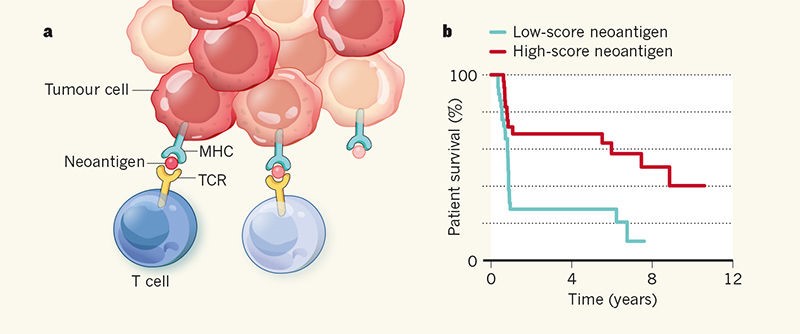
Hình 1. Dự đoán liệu rằng những đội biến ung thư sẽ kích hoạt đáp ứng miễn dịch a, Những phân mảnh của protein nội bào, được biết đến là kháng nguyên, gắn trên thụ thể MHC và được nhận diện bởi thụ thể nhận diện kháng nguyên của tế bào T (TCR) và kích hoạt một đáp ứng miễn dịch. Tế bào khối u chứa những kháng nguyên đột biến được gọi là neoantigens, đây là những tế bào bất thường trong cơ thể (sự biểu hiện của các neoantigens được chỉ thị bởi nền màu đỏ khác nhau). Mô hình nghiên cứu của Łuksza và cộng sự 2 đã cung cấp một điểm trên neoantigen nhận một đáp ứng miễn dịch trên cơ sở làm thế nào điểm này kết hợp với phân tử MHC và được nhận diện bởi TCR. Một điểm trên neoantigens có độ nhạy cao được đưa ra dự đoán được nhận diện và gây nên một đáp ứng miễn dịch mạnh đối với tế bào T (tế bào màu xanh đậm) và một điểm ái lực thấp được trên neoantigen được dự đoán để nhận diện một đáp ứng miễn dịch yếu hoặc tế bào T không đáp ứng (màu xanh nhạt). Các điểm nhận diện trên neoantigen ở mỗi dòng tế bào được sử dụng để dự đoán làm thế nào một khối u được kiểm soát bởi hệ thống miễn dịch. b. Balachandran và cộng sự 1chỉ ra loại mô hình này có thể được sử dụng để phân biệt giữa các cá nhân trong một nhóm người bị tử vong bởi ung thư tuyến tụy trong một thời gian sau khi chấn đoán hơn 8 năm (màu đỏ) hoặc ít hơn một năm (màu xanh).
Các tế bào khối u kháng lại sự giám sát của hệ thống miễn dịch bằng các cơ chế tự nhiên, điều này làm giảm đi đáp ứng miễn dịch để mà ngăn chặn các cuộc tấn công tự miễn chống lại các mô khỏe mạnh. Liệu pháp phong tỏa điểm kiểm soát có thể khóa những tín hiệu ứng chế miễn dịch được tạo ra bởi các điểm kiểm tra PD-L1 protein4. Tuy nhiên, chỉ có các khối u nhỏ được điều trị với liệu pháp này. Vì vậy cần thiết đưa ra những tiếp cận nghiên cứu để nhận diện các khối u mà đáp ứng lại liệu pháp miễn dịch.
Phương pháp hiện tại trong việc dự đoán tính hiệu quả của liệu pháp phong tỏa điểm kiểm soát phụ thuộc vào việc đo mức độ DP-L1 protein được biểu hiện bởi tế bào khối u, đếm số lượng tế bào T trong một phối u, và giới hạn số lượng neoantigens khác nhau chứa trong một khối u5. Nghiên cứu của Łuksza và Balachandran cũng như các cộng đã đưa ra một phương thức mới về mô hình tích hợp để dự đoán liệu rằng một khối u bị tấn công bởi tế bào T liên quan đến một sự tương thích của khối u (tumor fitness), cụ thể sự tương thích nhỏ sẽ liên kết với một đáp ứng miễn dịch mạnh chống lại khối u).
Các tác giả tính toán sự tương thích khối u được đánh giá bởi tính sinh miễn dịch của neoantigens điều mà một khối u chứa đựng. Để giới hạn tính sinh miễn dịch của mỗi neoantigen, các tác giả ban đầu xem xét làm thế nào một phân tử MHC của mỗi bệnh nhân kết hợp với neoantigen điều này được so sánh với kháng nguyên không đột biến, và thứ hai, họ đưa ra một điểm trên tương tác với MHC được nhận diện bởi TCR. Mặc dù hình thái của MHC có thể đa dạng và phụ thuộc vào loại MHC hiện diện, thuật tính toán có thể dự đoán chính xác ái lực của một kháng nguyên cho bất kỳ phân tử MHC nào được mã hóa trong bộ gen của bệnh nhân.
Tuy nhiên, dự doán kháng nguyên nào có khả năng được nhận diện cao hơn các kháng nguyên còn lại bởi TCRs vẫn còn đang là thách thức. Để giải quyết được vấn đề này, cả 2 nhóm tác giả nghiên cứu đã đơn giản hóa bằng cách giả định rằng neoantigens dường như có tính sinh miễn dịch cao, nếu chúng là các kháng nguyên liên quan đến bệnh truyền nhiễm sẽ kích hoạt tế bào T và vì vậy được nhận diện “không phải tự thân”.
Trong cả hai nghiên cứu, các tác giả đã tính toán sự tương thích của mội khối u trên cơ sở kết hợp giữa các tế bào trong khối u, được biết như là dòng “clone” có chứa các đột biến khác nhau. Mỗi clone trong khối u được đại diện bởi một điểm mà neoantigen của chúng có khả năng kết hợp với MHC và được nhận diện bởi TCR. Łuksza và các đồng nghiệp đã làm sáng tỏ mô hình của họ trọng một phân tích về ba nhóm người được chẩn đoán bị ung thư (hai nhóm bị chẩn đoán bị u hắc tố và một nhóm bị ng thư phổi tế bào không nhỏ) và đang được điều trị với liệu pháp phong tỏa điểm kiểm sóat. Các khối u được dự đoán bởi mô hình để có sự tương thích thấp hơn, có liên hệ tới việc kéo dài sự sống của bệnh nhân. Hơn thế nữa, họ cũng chỉ ra sự dự đoán trên toàn bộ mô hình cho kết quả tốt hơn các mô hình chỉ đánh giá từng phần.
Balachandran và cộng sự chỉ ra rằng sự tiếp cận loại mô hình này có thể phân biệt giữa sự sống kéo dài hay trong thời gian ngắn của bệnh nhân sau khi chẩn đoán mắc ung thư tuyến tiền liệt. Một mô hình thay thế được kiểm tra nhằm đánh giá số lượng neoantigens khác nhau. Hơn thế nữa, khi các mẫu máu từ bệnh nhân được phân tích, Balachandran và cộng sự đã nhận thấy rằng việc so sánh giữa những người sống lâu hơn so với những người sống trong thời gian ngắn lá do các neoantigens thường xuyên được tổng hợp từ đột biến trên gen MUC16 và có tế bào T phản ứng lại đột biến MUC16. Các tác giả đề xuất rằng các đột biến MUC16 tạo ra neoantigens là mục tiêu chính trong việc chống lại các khối u của hệ miễn dịch.
Mô hình khối u tương tích là một mô hình toán học trong đó có một vài thông số được thiết lập. Những thông số này liên quan đến thời gian của đáp ứng liệu pháp và việc đánh giá khả năng một neogantigen được nhận diện bởi TCR. Để phát hiện giá trị số học sử dụng cho các thông số này, cả 2 nhóm nghiên cứu đã đa dạng các giá trị thông số để mô hình thu được có sự phù hợp cao nhất với số liệu bệnh nhân sống sót được quan sát.
Łuksza và cộng sự đã sử dụng một cách tiếp cận trong đó các thông số được xác định thông qua việc sử dụng các số liệu từ một nhóm các bệnh nhân được sử dụng để dự đoán sự sống sót của một nhóm bệnh nhân độc lập. Đây là một phương thức chấp nhận được để tránh một vấn đề được biết đến như là sự phù hợp quá mức “over – fitting”, trong khi đó một mô hình chỉ làm việc trong một bộ dữ liệu cụ thể. Balachandran và cộng sự xác định các giá trị thông số và dự đoán hiệu quả sử dụng trên cùng một nhóm bẹnh nhân, nhưng đã tranh cãi về các giá trị tương tự thu thập được khi các dự liệu nhỏ được sử dụng cho mục đích thiết lập thông số này. Sự cần thiết để thiết lập các thông số mô hình cho mỗi nhóm bệnh nhân đặt ra câu hỏi làm thế nào dự đoán được mô hình cho mỗi bệnh nhân cụ thể khi xem xét đến những đặc điểm khác biệt của mỗi loại mô ung thư trên từng bệnh nhân và liệu pháp miễn dịch được sử dụng.
Nhiều nhân tố khác ảnh hưởng đến ái lực trong mối tương tác giữa phức hợp kháng nguyên – MHC proteins và TCR, điều này có thể ảnh hưởng đến hiệu lực của neoantigens hoặc tương quan đến tính hiệu quá của liệu pháp phong tỏa điểm kiểm soát. Vì vậy, thật sự cần thiết để mở rộng mô hình. Đáng chú ý, Łuksza và các đồng nghiệp đã chỉ ra sự kết hợp của các thông số bổ sung, cụ thể là sự biểu hiện của gen gây độc trong vi môi trường của khối u, điều này liên quan đến các tế bào miễn dịch đích của khối u, và chỉ ra rằng điều này cải thiện hiệu quả dự đoán của mô hình. Trên cơ sở đó, một mô hình nâng cao có thể đạt được bằng cách xem xét nhiều yếu tố như là quá trình thoái hóa protein (protein-degradation process) tạo ra các kháng nguyên hoặc mức độ biểu hiện của neoantigen.
Khả năng liên quan đến sự giống nhau giữa một neoantigen với một kháng nguyên không mã hóa bởi vi sinh vật (non-microbial antigens), như là kháng nguyên liên quan đến tự miễn có thể được sử dụng để dự đoán tính sinh miễn dịch và sự sống của bệnh nhân. Vì vậy những nghiên cứu tiếp theo cần chỉ ra bản chất của quá trình nhận diện kháng nguyên của TCR. Mặc dù có nhiều nhân tố cần được xem xét trong việc dự đoán tính hiệu của của đáp ứng miễn dịch chống ung thư ở các bệnh nhân (bao gồm kháng nguyên không bị đột biến, chúng có thể kích hoạt một đáp ứng chống ung thư), neoantigens được xem là một nhân tố đích để tế bào T có thể sử dụng và tiêu diệt tế bào ung thư và có vai trò quan trọng trong liệu pháp miễn dịch 6, 8.
Ghi chú: Bạn đọc có thể tìm hiểu thêm về liệu pháp miễn dịch trong điều trị ung thư thông qua đoạn video tại đây.
Nguồn : Nature
Biên dịch: Nguyễn Thị Thu Hoài
Tài liệu tham khảo:
1. Balachandran, V. P. et al. Nature 551, 512–516 (2017). Doi:10.1038/nature24462
2. Łuksza, M. et al. Nature 551, 517–520 (2017). Doi:10.1038/nature24473
3. Robins, H. Curr. Opin. Immunol. 25, 646–652 (2013). https://doi.org/10.1016/j.coi.2013.09.017
4. Sharma, P. & Allison, J. P. Science 348, 56–61 (2015). DOI: 10.1126/science.aaa8172
5. Schumacher, T. N. & Hacohen, N. Curr. Opin. Immunol. 41, 98–103 (2016). https://doi.org/10.1016/j.coi.2016.07.005
6. Carreno, B. M. et al. Science 348, 803–808 (2015). DOI: 10.1126/science.aaa3828
7. Ott, P. A. et al. Nature 547, 217–221 (2017). Doi:10.1038/nature22991
8. U. et al. Nature 547, 222–226 (2017). Doi:10.1038/nature23003


