Tác giả: Huỳnh Thị Diễm Phúc
Nguy cơ bệnh nhân chờ ghép gan chết trước khi tìm được gan hiến, hoặc tìm được gan hiến nhưng chất lượng gan không đạt yêu cầu, là một trong những nguy cơ dẫn đến thất bại trong ghép gan. Một thiết bị bảo quản gan cấy ghép có thể là giải pháp đầy hứa hẹn.
Phương pháp cơ bản để bảo quản gan trước cấy ghép được biết đến là phương pháp trữ đông. Trong nghiên cứu đăng trên Tạp chí Nature, nhóm tác giả Nasralla và cộng sự đã thử nghiệm lâm sàng và so sánh giữa phương pháp trữ đông truyền thống và phương pháp mới có tên NMP [1]. Phương pháp thứ hai được gọi là truyền dịch duy trì nhiệt độ cơ thể (Normothermic machine perfusion - NMP), cho phép kiểm soát nội tạng bên ngoài cơ thể trước khi cấy ghép. Ở thử nghiệm này, hơn 200 người ghép gan được chọn ghép ngẫu nhiên: gan được trữ đông hoặc được bảo quản bằng thiết bị duy trì ở nhiệt độ cơ thể (37oC) với máu được oxy hóa có chứa chất dinh dưỡng (tham khảo hình dưới).
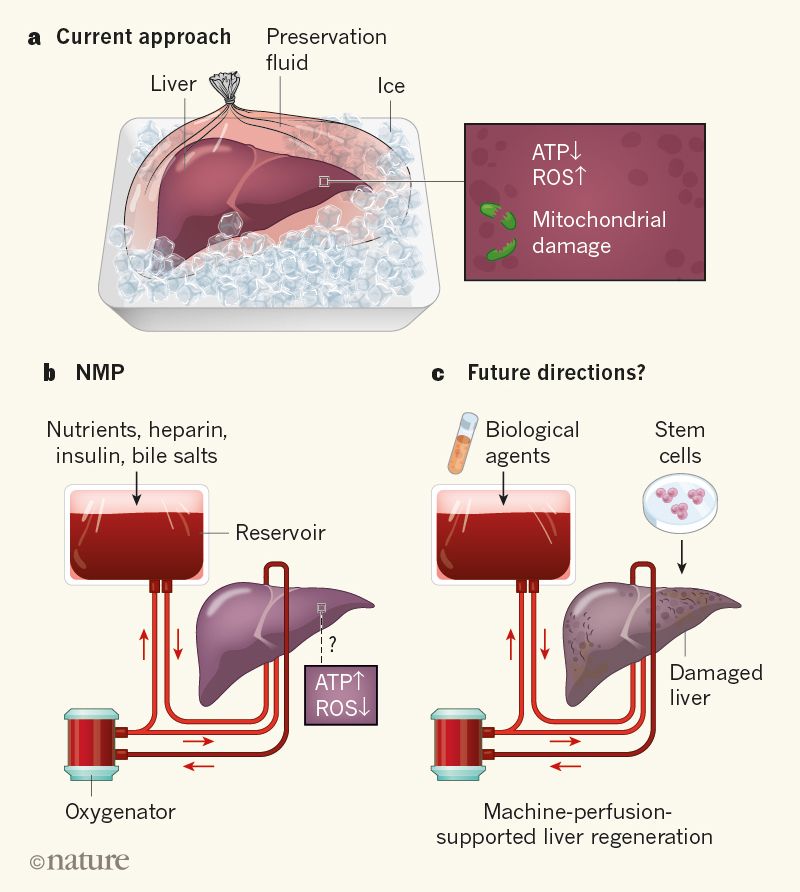
Hỗ trợ gan bên ngoài cơ thể
a, Phương pháp hiện tại: gan được trữ đông trong dịch bảo quản. Tuy nhiên, điều này có thể làm giảm mức lưu trữ năng lượng ATP, gia tăng các gốc oxy hóa tự do (Reactive Oxygen Species - ROS) và gây tổn thương các ty thể trong cơ thể khi máu lưu thông trở lại sau cấy ghép.
b, Phương pháp mới Normothermic Machine Perfusion (NMP): gan được giữ trong thiết bị đảm bảo nhiệt độ cơ thể (37°C). Thiết bị này bơm máu khử oxy (đỏ thẫm) từ gan qua máy, và bơm máu oxy hóa (đỏ tươi) chứa các chất dinh dưỡng và các yếu tố thiết yếu như muối mật, heparin và insulin vào gan. Trên cơ sở phân tích ở mức độ enzyme (không được hiển thị), tác giả ghi nhận phương pháp NMP ít gây ra tổn thương gan hơn so với phương pháp trữ đông. Điều này có thể do kết quả truyền dịch thể hiện ATP cao và ROS thấp hơn so với trữ đông.
c, Thiết bị dựa trên sự truyền máu trong cơ quan ở cơ thể có thể giúp chỉnh sửa tổn thương gan trước khi cấy ghép. Phương pháp này có thể yêu cầu phải bổ sung các tác nhân sinh học như các yếu tố tăng trưởng hoặc tế bào gốc.
Khái niệm về thiết bị truyền máu cho tạng hiến đang chờ cấy ghép không phải mới. Thực ra, trước khi phương pháp trữ đông được lựa chọn do tính chất đơn giản và khả năng tái sản xuất của nó [2], thiết bị trợ giúp đã được sử dụng. Tuy nhiên, việc cân nhắc lại phương pháp này nằm trong xu hướng phát triển.
Trong thử nghiệm mới nhất, kết quả chính được theo dõi là lượng enzyme aspartate transaminase sau cấy ghép trong máu bệnh nhân. Số liệu này thường được dùng trong đánh giá tổn thương gan và ước tính nguy cơ thất bại trong cấy ghép. Các tác giả nhận thấy rằng việc sử dụng NMP ít gây tổn thương gan hơn so với phương pháp trữ đông. Hơn nữa, bảo quản bằng NMP làm giảm số lượng cơ quan bị loại thải vì không tương thích và máu lưu thông tốt hơn ở người nhận so với bảo quản trữ đông.
Ống dẫn mật có thể là điểm yếu trong sự thành công của cấy ghép, và liệu NMP có tác động tích cực đến khả năng tồn tại của các ống dẫn này hay không? Đáp án cần có thời gian theo dõi lâu dài. Do đó, hiện tại quá sớm để khẳng định rằng công nghệ NMP là một phương pháp hiệu quả và phù hợp hơn cho việc lưu trữ tạng hiến cho đến khi các nghiên cứu bổ sung có thể xác định đầy đủ tính hiệu quả lâu dài. Nhưng phải nói rằng kết quả của Nasralla và đồng nghiệp thuyết phục về tính ưu việt của NMP. Hơn nữa, điều kiện bình thường giả định cho một cơ quan nội tạng bên ngoài cơ thể là một ý tưởng có sức thuyết phục. Thử nghiệm lâm sàng này đại diện cho một mốc quan trọng bằng cách so sánh trực tiếp các phương pháp trữ đông và NMP. Nó có thể mở đường cho việc áp dụng NMP trong lâm sàng và thúc đẩy nghiên cứu trong lĩnh vực này.
Cơ quan nội tạng trữ đông làm chậm quá trình trao đổi chất của gan và có thể gây tổn thương mô do việc giảm ATP. Sự thay đổi này dẫn đến việc tích lũy các gốc oxy hóa tự do, tổn thương ty thể, và kích hoạt phản ứng viêm khi máu lưu thông trở lại trong nội tạng được cấy ghép [3]. NMP có thể làm tăng khả năng thành công của cấy ghép bằng cách tạo điều kiện bình thường giả định cho nội tạng và cho phép bổ sung ATP. Tổng hợp các tác động trên sẽ hạn chế sự hình thành các phản ứng oxy hóa và tổn hại tế bào.
Mặc dù nghiên cứu của Nasralla và cộng sự mang tính thuyết phục về mặt lâm sàng của NMP, nhưng nó không làm rõ được ở mức phân tử. Các yếu tố như cấu trúc và thành phần tế bào sẽ cần được nghiên cứu chi tiết để xác định khoảng thời gian bảo quản, từ đó có thể sử dụng một cách an toàn. Các thử nghiệm lâm sàng khác về máy hỗ trợ truyền máu trong cơ quan nội tạng đang được thử nghiệm một loạt các mốc nhiệt độ và điều kiện khác nhau [4]. NMP đã được thực hiện thành công trên gan lợn trong 48 giờ trước khi cấy ghép [5]. Trong nghiên cứu của Nasralla và các đồng nghiệp, thời gian trung bình của NMP là khoảng 9 giờ.
Những tiến bộ tiên phong trong kỹ thuật phẫu thuật, điều trị bằng thuốc ức chế miễn dịch và chăm sóc bệnh nhân đã làm cho việc cấy ghép nội tạng là phương pháp điều trị chuẩn đối với bệnh nhân suy nội tạng mạn tính. Tuy nhiên, vẫn còn ba hạn chế cơ bản: thiếu tạng hiến, chất lượng của các tạng hiến suy giảm [6]; thời gian xử lý, vận chuyển tạng hiến bị hạn chế. Sử dụng NMP có thể làm tăng số lượng gan có sẵn để cấy ghép, làm giảm áp lực về thời gian cấy ghép ngay sau khi lấy khỏi cơ thể hiến tặng, do đó có thêm thời gian để đánh giá gan.
Tuy nhiên, NMP cũng đặt ra những thách thức nhất định. Việc thiết lập máy, chuẩn bị cơ quan để truyền máu và giải quyết vấn đề kỹ thuật cơ bản có thể đơn giản, nhưng quan trọng hơn là các đào tạo cần thiết và kinh nghiệm trong việc sử dụng phương pháp này trước khi đưa vào sử dụng thường xuyên trong phòng khám. Hơn nữa, vận chuyển và kế hoạch chăm sóc một cơ quan NMP phức tạp hơn so với trữ đông vì các bước phải thêm vào so với hoạt động thường quy. Cần thiết lập các quy trình (protocol) chuẩn và cách thức báo cáo để cho phép quy trình này nâng cao theo cách được kiểm soát. Các chia sẻ của chuyên gia y tế đã sử dụng NMP có thể giúp các bác sĩ lâm sàng có được kinh nghiệm cần thiết để giảm thiểu rủi ro về mặt thủ tục.
Có lẽ tiến bộ lớn nhất của công nghệ này là cung cấp bằng chứng về nguyên tắc rằng các cơ quan có thể tồn tại khi có thiết bị giúp tạo lập điều kiện tương tự trong cơ thể người. Bản thân gan người giống như một bệnh nhân. Nó được truyền dịch, theo dõi và cho ăn bởi một thiết bị. Nếu gan hoạt động tốt, nó sẽ được cấy ngay; nếu không, nó có thể trải qua điều trị, hoặc sửa chữa trước khi cấy ghép.
Việc sử dụng lâm sàng thường quy NMP có thể làm tăng sự quan tâm và đầu tư trong việc tìm ra phương pháp điều trị mới, tái sinh và tái tạo các cơ quan bên ngoài cơ thể. Khả năng bảo tồn một cơ quan dưới điều kiện gần như bình thường có thể là công cụ thúc đẩy không chỉ ghép gan, mà còn phẫu thuật gan và chăm sóc cơ quan. Kỹ thuật mô (như cấy ghép) hoạt động với mục đích cung cấp các bộ phận của con người thích hợp cho cấy ghép. Vì NMP cung cấp khả năng sửa đổi và giám sát một cơ quan, các phương pháp được sử dụng trong cả hai lĩnh vực có thể bắt đầu hợp nhất. Ý tưởng này rất hấp dẫn, bởi vì điều này không chỉ thay đổi nhiều khía cạnh của việc cấy ghép, mà còn có thể làm giảm khoảng cách giữa hai công nghệ.
Nguồn: https://www.nature.com/articles/d41586-018-04458-w
Tài liệu tham khảo:
1. Nasralla, D., Coussios, C. C., Mergental, H., Akhtar, M. Z., Butler, A. J., Ceresa, C. D., ... & Imber, C. (2018). A randomized trial of normothermic preservation in liver transplantation. Nature, 557(7703), 50.
2. Clark, E. A., Terasaki, P. I., Opelz, G., & Mickey, M. R. (1974). Cadaver-kidney transplant failures at one month. New England Journal of Medicine, 291(21), 1099-1102.
3. Eltzschig, H. K., & Eckle, T. (2011). Ischemia and reperfusion—from mechanism to translation. Nature medicine, 17(11), 1391.
4. Verhoeven, C. J., Farid, W. R., de Jonge, J., Metselaar, H. J., Kazemier, G., & van der Laan, L. J. (2014). Biomarkers to assess graft quality during conventional and machine preservation in liver transplantation. Journal of hepatology, 61(3), 672-684.
5. Vogel, T., Brockmann, J. G., Pigott, D., Neil, D. A. H., Muthusamy, A. S. R., Coussios, C. C., & Friend, P. J. (2017). Successful transplantation of porcine liver grafts following 48-hour normothermic preservation. PLoS ONE, 12(11), e0188494. http://doi.org/10.1371/journal.pone.0188494
6. Orman, E. S., Barritt, A. S., Wheeler, S. B., & Hayashi, P. H. (2013). Declining liver utilization for transplantation in the United States and the impact of donation after cardiac death. Liver Transplantation, 19(1), 59-68.


