Tổng hợp và biên dịch: Huỳnh Thị Diễm Phúc
Phần 1: Giới thiệu về ngoại kiểm tra chất lượng
Sự cần thiết của kiểm soát, đảm bảo chất lượng
Tất cả các hoạt động có sản phẩm đầu ra cụ thể như nghiên cứu khoa học, sản xuất các loại sản phẩm, cung cấp dịch vụ… đều yêu cầu kết quả đầu ra này phải đạt chất lượng. Riêng lĩnh vực xét nghiệm, yêu cầu chất lượng của kết quả là vô cùng quan trọng. Vì chất lượng các kết quả này cung cấp thông tin cho các chẩn đoán chính xác của bác sĩ. Từ đó mang lại cho bệnh nhân các kết quả tối ưu, tiết kiệm chi phí cho cả bệnh nhân và xã hội, đặc biệt có những chi phí đắt hơn cả chi phí khám và điều trị, đó là sức khỏe, sinh mạng của con người.
Hiện nay, các hướng dẫn và thực hành về quản lý chất lượng phòng xét nghiệm tiếp tục phát triển (1). Bên cạnh đó, thuật ngữ "kiểm soát chất lượng" (quality control - QC) đã được giới thiệu từ trước. Thuật ngữ này đề cập đến "kiểm soát chất lượng thống kê thường được sử dụng trong phòng thí nghiệm để theo dõi kết quả thường quy của quy trình xét nghiệm, phát hiện lỗi và sửa chữa các vấn đề về lỗi trước khi trả kết quả xét nghiệm” (2). Để theo dõi và cải tiến chất lượng chẩn đoán của phòng thí nghiệm cần kết hợp nội kiểm tra chất lượng (gọi tắt là nội kiểm - Internal Quality Control - IQC), ngoại kiểm tra chất lượng (gọi tắt là ngoại kiểm - External Quality Assessment – EQA) và nhiều công cụ khác (3).
Để đạt và chứng minh theo tiêu chuẩn quốc tế về chất lượng và năng lực (ISO 15189 đối với phòng xét nghiệm, ISO 17025 đối với phòng thử nghiệm), các phòng thử nghiệm/ xét nghiệm đều phải đảm bảo điều kiện bắt buộc: thực hiện và đạt các kết quả ngoại kiểm/ thử nghiệm thành thạo/ so sánh liên phòng (4, 5).
Như vậy ngoại kiểm (EQA), thử nghiệm thành thạo (PT), so sánh liên phòng (inter-laboratory comparison) là gì và có thể thay thế cho nhau hay không?
Giới thiệu ngoại kiểm
Theo CLSI (Viện tiêu chuẩn lâm sàng và xét nghiệm Hoa Kỳ -Clinical and Laboratory Standards Institute), các thuật ngữ ngoại kiểm tra chất lượng (EQA) và thử nghiệm thành thạo (PT) được sử dụng như nhau trong vai trò là các công cụ trong quá trình cải tiến chất lượng dịch vụ phòng thí nghiệm lâm sàng. Theo nghĩa phổ biến, PT là “chương trình mà trong đó các mẫu được gửi định kỳ đến từng phòng thành viên của một nhóm các phòng thí nghiệm. Các phòng thí nghiệm tham gia thực hiện cả hai hoặc một trong hai nội dung: phân tích và định danh. Kết quả của các phòng thí nghiệm được so sánh với nhau và với giá trị ấn định, đôi khi chỉ so sánh với giá trị ấn định. Kết quả so sánh này được gửi lại cho phòng thí nghiệm tham gia và những đơn vị khác” (3).
Mặt khác, theo WHO (tổ chức y tế thế giới - World Health Organization), thuật ngữ ngoại kiểm tra chất lượng (EQA) được sử dụng để mô tả một phương pháp cho phép so sánh thử nghiệm/ xét nghiệm của một phòng thí nghiệm với một phòng thí nghiệm bên ngoài. Sự so sánh này có thể được thực hiện trong một nhóm các phòng thí nghiệm có chất lượng ngang hàng hoặc với một phòng thí nghiệm tham chiếu.
Thuật ngữ EQA và PT đôi khi được sử dụng thay thế cho nhau, mặc dù EQA cũng có thể được thực hiện bằng nhiều phương pháp khác nhau. Các phương pháp EQA phổ biến:
- So sánh liên phòng (PT): nhà cung cấp bên ngoài gửi các mẫu không biết trước để kiểm một nhóm các phòng thí nghiệm. Các kết quả của tất cả các phòng thí nghiệm được gửi về cho nhà cung cấp. Kết quả này được phân tích, so sánh và gửi báo cáo trở lại các phòng thí nghiệm.
- Kiểm tra lại/ đánh giá lại (re-checking/ re-testing): phòng thí nghiệm tự phân tích mẫu, sau đó gửi mẫu đến phòng thí nghiệm tham chiếu phân tích lại, sau đó so sánh kết quả. Hoặc phòng thí nghiệm phân tích một mẫu đã được phòng thí nghiệm tham chiếu thực hiện, sau đó so sánh hai kết quả lại với nhau.
- Đánh giá tại chỗ (on-site evaluation): thường được thực hiện khi gặp khó khăn trong cả 2 phương pháp trên.
Ngoài ra, còn một phương pháp khác, đó là so sánh liên phòng (inter-laboratory comparison) là việc trao đổi mẫu giữa các phòng thí nghiệm sau đó so sánh kết quả lẫn nhau. Phương pháp này thường được sử dụng khi thử nghiệm/ xét nghiệm chuyên biệt nào đó không có cơ quan cung cấp chương trình EQA/ PT (6).
Như vậy thì EQA hay PT đều được hiểu là một hệ thống để kiểm tra khách quan chất lượng của phòng thí nghiệm thông qua cơ quan đánh giá bên ngoài (6). Cả hai đều cung cấp bằng chứng khách quan về năng lực phòng thí nghiệm cho khách hàng, cơ quan kiểm định và các cơ quan quản lý. Đối với các cơ quan kiểm định và cơ quan quản lý, công cụ này cung cấp dữ liệu khách quan về chất lượng dịch vụ cung cấp, vì kết quả EQA/ PT phản ánh chất lượng xét nghiệm bệnh phẩm (7, 8).
Do đó, trong bài viết này, PT và EQA được xem là như nhau giữa các nội dung.
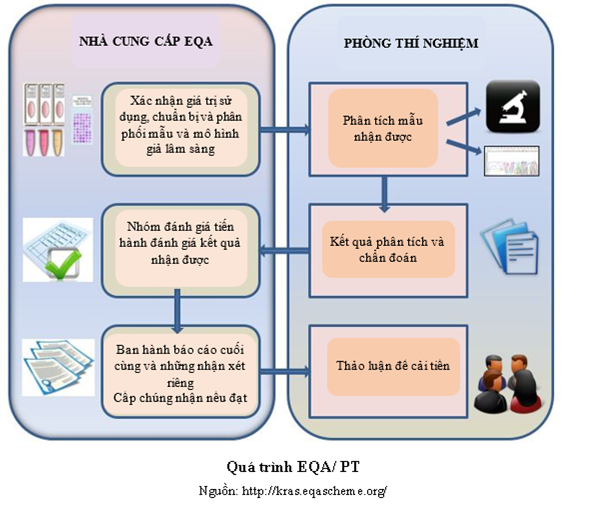
Quá trình thực hiện ngoại kiểm
EQA/ PT là đánh giá bên ngoài về chất lượng của phòng thí nghiệm so với hệ thống tham chiếu dựa trên độ chính xác và đồng đẳng của nó (9). Một khảo sát EQA/ PT được thực hiện bằng cách: cơ quan tổ chức EQA/ PT sẽ gửi mẫu đến phòng thí nghiệm tham gia, để đánh giá cách phòng thí nghiệm thực hiện tương tự như trên các mẫu lâm sàng. Các mẫu EQA/ PT này được thiết kế mô phỏng các mẫu lâm sàng thường được thực hiện tại phòng thí nghiệm. Các phòng thí nghiệm tiến hành thực hiện trên mẫu nhận được. Sau đó, các kết quả được gửi trở lại cơ quan tổ chức EQA/ PT để cơ quan này đánh giá sự phù hợp với kết quả mong đợi đối với các mẫu đó. Bản báo cáo từ cơ quan tổ chức EQA/ PT bao gồm kết quả do phòng thí nghiệm gửi về, phương pháp đo lường, giá trị mong đợi đối với mỗi đo lường trong từng mẫu, sự phân phối các kết quả trong khảo sát và đánh giá khả năng chấp nhận. Khi kết quả phòng thí nghiệm đạt, cơ quan tổ chức EQA sẽ cấp giấy chứng nhận cho phòng thí nghiệm tham gia.
Tài liệu tham khảo:
1. Westgard JO. (2010). Managing quality vs. measuring uncertainty in the medical laboratory. Clin Chem Lab Med, 48, 3-40.
2. Westagard JO. (2003). Internal quality control: planning and implementation strategies. Ann Clin Biochem, 40, 593-611.
3. Clinical and Laboratory Standards Institute (CLSI) (2007). Using Proficiency Testing to improve the clinical laboratory; Approved Guideline-Second Edition. CLSI document GP27-A2. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA.
4. ISO/IEC 17025:2017, General requirements for the competence of testing and calibration laboratories
5. ISO 15189:2012, Medical laboratories - Requirements for quality and competence
6. World Health Organization (WHO), External quality assessment, module 10. http://www.who.int/ihr/training/laboratory_quality/10_b_eqa_contents.pdf
7. Hoeltge GA, Duckworth JK. (1987). Review of proficiency testing performance of laboratory accredited by the College of American Pathologists. Arch Pathol Lab Med, 111, 1011-4.
8. Jenny RW, Jackson KY. (1993) Proficiency test performance as a predictor of accuracy of routine patient testing for theophylline. Clin Chem, 39, 76-81.
9. Miller WG. (2008) The role of proficiency testing in achieving standardization and harmonization between laboratories. Clin Biochem, 42, 232-8.


