Tổng hợp và biên dịch: Nguyễn Huỳnh Thanh Tuấn
Khoa Y – Đại học Quốc gia Thành phố Hồ Chí Minh
Email: tuannguyenhuynhthanh@gmail.com
Các nhà khoa học đến từ Đại học John Hopkins đã sử dụng hệ thống CRISPR/Cas9* để làm bất hoạt một gene đóng vai trò then chốt đối với sự phát triển của ký sinh trùng sốt rét trong cơ thể của muỗi Anopheles gambiae. Kết quả thử nghiệm bước đầu cho thấy những cá thể muỗi bị biến đổi gene có khả năng kháng được loại ký sinh trùng này.
*Ghi chú: CRISPR/ Cas9 là tên viết tắt của Clustered Regularly Interspaced Short Palindromic Repeat / CRISPR-associated nuclease 9
Giới thiệu sơ lược về vòng đời của ký sinh trùng sốt rét
Sốt rét là bệnh truyền nhiễm cực kỳ nguy hiểm gây ra bởi một loại ký sinh trùng có tên khoa học là Plasmodium, do muỗi Anopheles truyền từ người bệnh sang người lành (1). Cho đến nay, có 5 loài Plasmodium được biết đến là nguyên nhân gây ra bệnh sốt rét ở người, đó là: P. falciparum, P. vivax, P. ovale, P. malariae, P. knowlesi (2). Theo thống kê, mỗi năm có đến hơn hai trăm triệu ca mắc bệnh và số người tử vong bởi sốt rét lên đến khoảng nửa triệu người (1, 3). Vì thế, sốt rét đã và đang trở thành một gánh nặng bệnh tật mang tính toàn cầu. Do đó, việc làm sao có thể loại trừ được dịch bệnh này là vấn đề thu hút được rất nhiều sự quan tâm của các nhà khoa học.
Có thể nói, để gây bệnh sốt rét, ký sinh trùng Plasmodium phải hoàn thành một chu kỳ phát triển rất phức tạp ở hai ký chủ: ở cơ thể người (giai đoạn vô tính) và ở cơ thể muỗi (giai đoạn hữu tính).
Thời kỳ ký sinh ở người gồm 2 giai đoạn: (4, 5)
Giai đoạn ngoài hồng cầu (Exoerythrocytic phase):
Khi muỗi đốt cơ thể người, thoa trùng (sporozoites) theo nước bọt được bơm vào máu người. Sau đó, các thoa trùng này sẽ xâm nhập tế bào gan, nơi chúng sẽ phát triển thành tiết trùng gan (merozoites) rồi tiến triển thành thể phân liệt (schizonts). Sau đó, thể phân liệt này sẽ phá vỡ tế bào gan, phóng thích các tiết trùng vào máu. Đến đây, giai đoạn ngoài hồng cầu chấm dứt, nhưng chỉ riêng đối với P. falciparum. Còn đối với P.vivax, P.ovale, một số thoa trùng ở lại gan dưới dạng “thể ngủ” (hypnozoite) trong một khoảng thời gian rồi sau đó mới phát triển thành tiết trùng gan để vào máu. Do đó, giai đoạn này vẫn còn tồn tại kéo dài và có thể phóng thích những đợt tiết trùng vào máu gây nên những trường hợp tái phát sốt rét.
Giai đoạn trong hồng cầu (Erythrocytic phase):
Các tiết trùng từ tế bào gan sẽ tiết vào máu, xâm nhập vào tế bào hồng cầu rồi phát triển qua thể nhẫn, sau thành thể tư dưỡng (non, già), thể phân liệt rồi cuối cùng phá vỡ hồng cầu và các tiết trùng hồng cầu trong thể phân liệt được giải phóng ra ngoài, một số xâm nhập vào hồng cầu khác, một số thì phát triển thành thể hữu tính (giao bào đực và cái – gametocyte).
Thời kỳ ký sinh ở muỗi: (4, 5)
Khi muỗi Anopheles đốt một bệnh nhân bị sốt rét, nó sẽ hút vào dạ dày các thể vô tính và hữu tính. Chỉ có các thể hữu tính (giao bào) mới tiếp tục phát triển được. Những giao bào này sẽ phát triển thành giao tử (gamete), sau đó thành hợp tử (zygote) và trứng “di động” (ookinete). Các trứng “di động” này chui qua thành dạ dày và phát triển ở mặt ngoài dạ dày để thành nang trứng (oocyst). Sau đó, các nang trứng này lớn lên, vỡ ra và giải phóng các thoa trùng. Cuối cùng, thoa trùng, di chuyển về tuyến nước bọt (salivary gland) của muỗi để tiếp tục truyền vào người khi muỗi đốt.
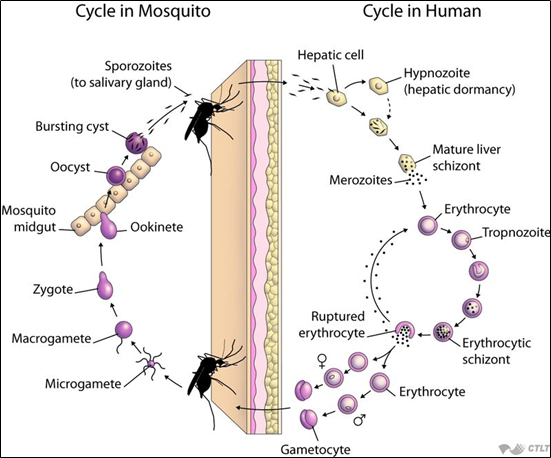
Hình 1. Chu kỳ phát triển của ký sinh trùng sốt rét (John Hopkins Bloomberg School of Public Health)
“Chuyến hành trình gian nan” này của ký sinh trùng Plasmodium phải cần đến sự hỗ trợ rất lớn từ các tương tác sinh học ở cấp độ phân tử tại thành dạ dày, hemolymph, tuyến nước bọt của muỗi Anopheles (6) mà bản chất là sự tương tác giữa các chất chủ vận (agonists) của ký sinh trùng sốt rét (giải thích: chất chủ vận là một chất hóa học có thể bám vào thụ quan (receptor) và gây nên các đáp ứng sinh học) với các thụ quan (receptor) của muỗi.
Hiểu được điều này, trong suốt nhiều năm qua, các nhà khoa học đã nghiên cứu và phát triển nhiều phương thức để ngăn chặn việc ký sinh trùng Plasmodium có thể phát triển được bên trong cơ thể muỗi Anopheles, hay nói khác đi là tạo dòng muỗi Anopheles có khả năng kháng được ký sinh trùng sốt rét, bằng cách cản trở sự tương tác sinh học ấy. Những nỗ lực này đã mang lại những kết quả bước đầu hết sức khả quan như: những nghiên cứu về kỹ thuật gây đột biến mất gene mã hóa cho một số chất chủ vận, hay làm bất hoạt RNA (RNA silencing) thông qua RNAi (RNA interference) hoặc sử dụng kháng thể (7-9).
Còn tiếp
Tài liệu tham khảo:
1. World Health Organization (WHO) (2014) Malaria: fact sheet. (World Health Organization. Regional Office for the Eastern Mediterranean).
2. Center for Disease control and Prevention (CDC) (2018) Biology: Malaria Parasites.
3. Murray CJ, et al. (2012) Global malaria mortality between 1980 and 2010: a systematic analysis. The Lancet 379(9814):413-431.
4. Bùi Đại NVM, Nguyễn Hoàng Tuấn (2005) Bệnh học truyền nhiễm p 231.
5. Nguyễn Trần Chính NHC, Lê Bửu Châu, Nguyễn Văn Hảo, Phan Thị Lệ Hoa, Nguyễn Thế Hùng, Võ Thị Thiên Hương, Cao Ngọc Nga, Nguyễn Duy Phong, Đông Thị Hoài Tâm, Nguyễn Thị Thu Thảo, Đinh Thế Trung (2008) Bệnh truyền nhiễm (Y học) p 397.
6. Ghosh A, Edwards M, & Jacobs-Lorena M (2000) The journey of the malaria parasite in the mosquito: hopes for the new century. Parasitology Today 16(5):196-201.
7. Dinglasan RR, et al. (2007) Disruption of Plasmodium falciparum development by antibodies against a conserved mosquito midgut antigen. Proceedings of the National Academy of Sciences 104(33):13461-13466.
8. Mendes AM, et al. (2008) Conserved mosquito/parasite interactions affect development of Plasmodium falciparum in Africa. PLoS Pathogens 4(5):e1000069.
9. Osta MA, Christophides GK, & Kafatos FC (2004) Effects of mosquito genes on Plasmodium development. science 303(5666):2030-2032.
10. Doudna JA & Charpentier E (2014) The new frontier of genome engineering with CRISPR-Cas9. Science 346(6213):1258096.
11. Hall AB, et al. (2015) A male-determining factor in the mosquito Aedes aegypti. Science 348(6240):1268-1270.
12. Dong Y, Simões ML, Marois E, & Dimopoulos G (2018) CRISPR/Cas9-mediated gene knockout of Anopheles gambiae FREP1 suppresses malaria parasite infection. PLoS pathogens 14(3):e1006898.
13. Li J, et al. (2013) Genome-block expression-assisted association studies discover malaria resistance genes in Anopheles gambiae. Proceedings of the National Academy of Sciences 110(51):20675-20680.
14. Zhang G, et al. (2015) Anopheles midgut FREP1 mediates Plasmodium invasion. Journal of Biological Chemistry:jbc. M114. 623165.
15. John Hopkins Bloomberg School of Public Health (2018) Gene Knockout Using New CRISPR Tool Makes Mosquitoes Highly Resistant to Malaria Parasite.
16. Chen JS, et al. (2017) Enhanced proofreading governs CRISPR–Cas9 targeting accuracy. Nature 550(7676):407.
17. Frock RL, et al. (2015) Genome-wide detection of DNA double-stranded breaks induced by engineered nucleases. Nature biotechnology 33(2):179.
18. Fu Y, et al. (2013) High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature biotechnology 31(9):822.


