Trần Phương Anh, PhD
Medicinal Chemistry,
Nha Trang University, Vietnam
Mỗi sinh vật trên Trái Đất đều có hành vi và nhận thức riêng, tương ứng với từng thời điểm trong một ngày, nhờ vào đồng hồ sinh học bên trong cơ thể.
Trong vài thập kỷ qua, những đổi mới về công nghệ đã tác động đến xã hội loài người một cách đáng kinh ngạc, không thể phủ nhận những thay đổi này là tốt hơn. Tuy nhiên, cuộc sống càng hiện đại, chúng ta càng phải đối mặt với nhiều yếu tố làm ảnh hưởng đến đồng hồ sinh học: sự di chuyển đến các vùng múi giờ khác nhau, sự ra đời của internet, công nghệ sản xuất ngày và đêm...phần nào nguy hại đến sức khoẻ và tâm sinh lý cho con người.
Những công trình nghiên cứu vừa được vinh danh trong giải Nobel Y sinh 2017 giúp chúng ta hiểu rõ về cơ chế vận hành ở cấp độ phân tử của chiếc đồng hồ sinh học này.
Đồng hồ sinh học và chức năng
Đồng hồ sinh học (ĐHSH) có nhiệm vụ “theo dõi” thời gian và kiểm soát hoạt động của cơ thể trong chu kỳ của một ngày - đêm (khoảng 24 giờ), tương ứng với sự quay quanh trục của trái đất. Chúng có mặt ở hầu hết mọi cá thể sống: vi khuẩn, nấm, thực vật, ruồi giấm, động vật có vú và con người.(1) Trong thế giới hoang dã, ĐHSH giúp sinh vật dự đoán và thích nghi với sự thay đổi của môi trường sống như chu kỳ ngày – đêm của ánh sáng, nhiệt độ, ý thức các thời điểm ăn, ngủ thậm chí thời điểm những kẻ săn mồi hoạt động.
Mỗi chiếc ĐHSH có thể giữ nhịp điệu riêng của nó và thường xuyên “đồng bộ” với những thay đổi của môi trường ngoài. Điều này rất quan trọng vì ánh sáng và nhiệt độ biến động theo ngày và theo mùa, một sự thay đổi đột ngột các yếu tố đó sẽ gây ảnh hưởng không tốt đến cơ thể, đòi hỏi ĐHSH phải thích nghi và tự lập trình lại theo sự thay đổi đó.(2)
Cấu tạo của ĐHSH gồm 3 phần chính được biểu diễn trong hình 1: (1) Đầu vào (Input): cung cấp nguồn ánh sáng, nhiệt độ... tương ứng với từng thời điểm của chu kỳ ngày – đêm của môi trường ngoài; (2) Trung tâm điều khiển (the center pacemaker): dao động với chu kỳ khoảng 24 giờ, có nhiệm vụ theo dõi thời gian và kiểm soát đầu ra của ĐHSH; (3) Đầu ra (Output): điều hoà các chức năng như: hành vi, điều tiết hormone, giấc ngủ, thân nhiệt, sự trao đổi chất...của cơ thể.
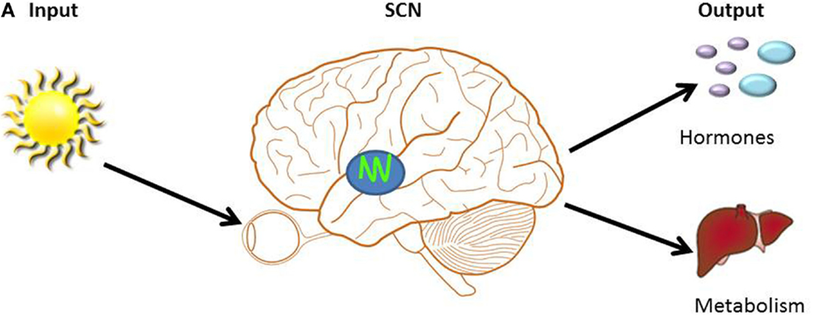
Sự tồn tại của ĐHSH trong mỗi cơ thể sinh vật đã được biết đến từ lâu, tuy nhiên cơ chế hoạt động của nó vẫn còn là một ẩn số. Do đó, có rất nhiều nghiên cứu tập trung nỗ lực làm sáng tỏ ẩn số này. Để hiểu rõ tầm quan trọng của ĐHSH với đời sống con người, chúng ta hãy tìm hiểu xem chuyện gì sẽ xảy ra nếu có sự mất “đồng bộ” giữa ĐHSH bên trong và môi trường bên ngoài?
Một ví dụ dễ hiểu nhất đó là hiện tượng lệch múi giờ (Jetlag). Khi chúng ta di chuyển đến vùng có múi giờ khác, cơ thể vẫn “ghi nhớ” múi giờ cũ, bao gồm thời gian thức – ngủ, ăn uống.... Cơ thể cần một vài ngày để thích ứng với sự thay đổi này và chúng ta cảm thấy mệt mỏi trong thời gian đó như là một hệ quả tất yếu.
Trong xã hội hiện đại ngày nay, sự rối loạn ĐHSH rất thường xuyên xảy ra: làm việc nhiều giờ liên tục, làm việc với đối tác nước ngoài vào các khung giờ ngoài hành chính, những chuyến công tác thất thường hoặc ngay cả “social jet lag” – hiện tượng do chúng ta ăn ngủ thất thường vào cuối tuần. Rối loạn ĐHSH trong thời gian ngắn gây ảnh hưởng đến khả năng tiếp thu và ghi nhớ, rối loạn chức năng miễn dịch...làm giảm chất lượng cuộc sống. Rối loạn ĐHSH lâu dài (mãn tính) gây ra các vấn đề về sức khoẻ, làm tăng nguy cơ mắc các bệnh lý như béo phì, đái tháo đường, ung thư, tim mạch, trầm cảm...(4–7)
Nghiên cứu chuyên sâu về ĐHSH là rất cần thiết nhằm hiểu rõ hậu quả của rối loạn NSH và cách chữa trị. Rất nhiều câu hỏi được đặt ra: ĐHSH “theo dõi” thời gian bằng cách nào? Làm thế nào chúng đồng bộ với môi trường và điều chỉnh ở những vùng múi giờ khác nhau? Tại sao có những người lại có giấc ngủ khác biệt so với người khác?
Đồng hồ sinh học “theo dõi” thời gian bằng cách nào?
Trải qua gần 50 năm, kể từ khi TS. Seymour Benzer phát hiện gene Period ở ruồi giấm,(8) các nhà khoa học đã làm sáng tỏ cơ chế hoạt động của ĐHSH ở cấp độ phân tử. Bằng cách sử dụng ruồi giấm làm mô hình nghiên cứu, các thành phần cơ bản của ĐHSH đã được xác định, hàng loạt các gene tham gia vào bộ máy này được tìm ra và xác định chức năng.(9–12) Các loài ruồi giấm, động vật có vú và con người có chung một cơ chế cốt lõi của ĐHSH và được lưu truyền qua hơn 600 triệu năm tiến hoá.
Cơ chế hoạt động của ĐHSH phụ thuộc vào dao động trong một ngày của các protein liên quan và các vòng lặp phản hồi âm (negative transcriptional feedback loops). Có hai vòng lặp trong cơ chế này: vòng Period/Timeless (Per/Tim) và vòng Clock/Cycle (Clk/Cyc) (Hình 2). Các protein này tự điều chỉnh mức độ sản sinh của chính nó theo một nhịp tuần hoàn liên tục. (1)
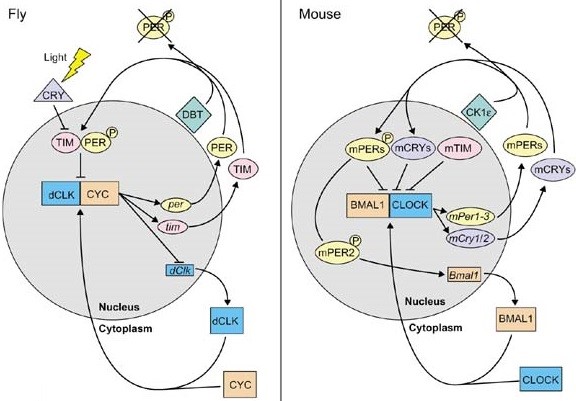
Hình 2: Cơ chế cấp độ phân tử của ĐHSH ở ruồi (trái) và ở chuột (phải). ĐHSH ở cả ruồi giấm và chuột đều được kiểm soát bởi 2 vòng lặp. Mặc dù có những điểm khác biệt giữa các loài, cấu trúc vòng lặp là tương đối giống nhau.(13)
Ở vòng Clk/Cyc, số lượng 2 protein Clock và Cycle tăng trong ngày và sau đó giảm dần khi ánh sáng mặt trời mất đi. Khi đã tích tụ một lượng đủ trong tế bào, chúng gắn kết lại với nhau (heterodimerization) và kích hoạt 2 gene: Period và Timeless, từ đó dịch mã cho 2 protein tương ứng Period và Timeless. Như vậy vào ban ngày, tế bào sản xuất hàng loạt protein Period và Timeless, tuy nhiên chúng liền bị phân huỷ bởi ánh sáng mặt trời (light-activated mechanisms). Khi đêm xuống, số lượng các protein này mới tăng lên dần. Vòng Per/Tim là sự đảo ngược của vòng Clk/Cyc vì sẽ có mức protein Period và Timeless thấp trong ngày và tăng dần lên sau khi trời tối. Khi 2 protein Period và Timeless được tích tụ đủ trong tế bào, chúng gắn kết lại với nhau và cùng ức chế protein Clock và Cycle, dẫn đến bất hoạt 2 gene Period và Timeless và ức chế sự sản xuất các protein tương ứng: Period và Timeless. Tương tự, một ngày mới bắt đầu và ánh sáng lại làm phân huỷ protein Period và Timeless, chu kỳ này lại bắt đầu, phối hợp nhịp nhàng với môi trường ngoài ứng với từng thời điểm trong ngày.
Trên đây là nguyên lý cơ bản của chu trình hoạt động của ĐHSH trong cơ thể và đương nhiên, còn rất nhiều gene khác tham gia vào 2 vòng lặp này và điều hoà đầu ra của ĐHSH: hành vi, giấc ngủ, điều tiết hormone, trao đổi chất...Các vòng lặp này đều được tìm thấy trên ruồi, động vật có vú và nhiều loài khác, chứng tỏ đây là một bộ máy tối ưu cho việc lưu giữ thời gian. Một điều quan trọng là mặc dù mỗi tế bào có thể tự nó duy trì một nhịp sinh học riêng và đồng bộ với môi trường ngoài, giữa chúng phải có “sự giao tiếp” với nhau để duy trì sự đồng bộ tổng thể. (14)
Làm thế nào ĐHSH đồng bộ với môi trường và tự điều chỉnh ở những vùng múi giờ khác nhau?
Chu kỳ của ĐHSH thực tế dài hơn 24 giờ, trong khi độ dài của một ngày lại có thể thay đổi khác nhau tuỳ theo vị trí địa lý và theo mùa. Các nghiên cứu cho thấy, ĐHSH này có thể “tự cài đặt lại” khi cơ thể tiếp xúc với ánh sáng lạ hoặc sự biến động của nhiệt độ. Vậy làm thế nào những biến đổi bên ngoài cơ thể lại có thể “cài đặt lại” ĐHSH? (1)
Ở ruồi, ánh sáng đi vào não bộ thông qua đầu và mắt. Ánh sáng này phá vỡ protein Timeless và ngăn chặn sự tích tụ của nó trong ngày. Vào ban đêm, proteine Timeless lại được tích tụ đủ trong tế bào. Tuy nhiên, khi có sự biến động của ánh sáng (ví dụ có luồng ánh sáng lạ vào lúc tối muộn hoặc sáng sớm), các protein Timeless bị phá vỡ bởi luồng ánh sáng này làm cho bộ não “nghĩ” rằng: chu kỳ ngày mới đã bắt đầu và “cài đặt lại thời gian” cho ĐHSH. Có một số gene khác tham gia vào sự cài đặt lại này, trong đó có Crytochrome và Jetlag. (15) Năm 2006, người ta phát hiện rằng nếu làm đột biến gene Jetlag, ruồi sẽ không còn khả năng “cài đặt lại” ĐHSH khi tiếp xúc với các biến động của ánh sáng trong phòng thí nghiệm. Gene Jetlag này cũng được tìm thấy ở người, giải thích cho sự thích ứng khác nhau của mỗi người sau khi di chuyển đến các vùng có múi giờ khác.
Đồng hồ sinh học và giấc ngủ (16)
Giấc ngủ rất quan trọng đối với tất cả các loài sinh vật. Sau những nghiên cứu về giấc ngủ của hàng nghìn con ruồi giấm với các loại đột biến gene khác nhau, Koh và Wu cùng đồng nghiệp đã tìm ra gene Wake – mặc dù không tham gia vào sự vận hành của ĐHSH, nó lại quan trọng trong việc truyền tín hiệu cho cơ thể ý thức được giờ ngủ vào cuối ngày. Các tế bào đồng hồ (clock cells) là nhóm các tế bào cấu tạo nên trung tâm điều khiển của ĐHSH – lưu trú trên não bộ tại SCN (suprachiasmatic nucleus) ở động vật có vú. Ở ruồi giấm, trung tâm điều khiển này chứa các neuron LNvs (The large ventrolateral neurons) – các neuron duy trì sự tỉnh táo. Ban ngày, các neuron này hoạt động liên tục khiến ruồi giấm tỉnh táo. Ban đêm, lượng protein Wake được dịch mã từ gene Wake tăng lên (chu kỳ của Wake trong các neurons LNvs phối hợp nhịp nhàng với vòng lặp Clk/Cyc), dẫn đến các tế bào dễ bị ức chế bởi các tín hiệu hoá học GABA (chemical messenger) và trở nên “kém hoạt động”. Các neurons LNvs trở nên “nhạy” hơn với GABA, khiến chúng “kém hoạt động” hơn và gây buồn ngủ. Nói cách khác, ruồi giấm bị đột biến ở gene Wake sẽ không nhận đủ tín hiệu GABA để “ức chế” các neuron LNvs, dẫn đến chúng sẽ vẫn “năng động” vào ban đêm và mất ngủ. (Hình 3).
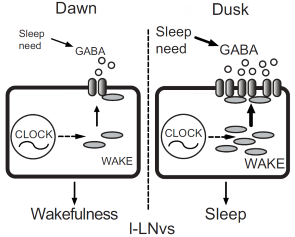
Hình 3. Cơ chế gây ngủ của các neurons LNvs ở ruồi giấm: (Trái) Ban ngày, rất ít tín hiệu GABA ở não ruồi được truyền tới các neuron LNvs. (Phải) Ban đêm, lượng protein Wake tăng lên, làm tăng số lượng thụ thể GABA trên màng tế bào, các tế bào trở nên “nhạy” với GABA. Điều này gây “ức chế” các LNvs, làm ruồi buồn ngủ vào buổi tối. Nguồn: https://blogs.brandeis.edu.
Các tác giả cũng đã tìm thấy gene Wake trên SCN ở động vật có vú. Đột biến gene Wake gợi nhớ tới Insomia – chứng mất ngủ ở người. Hiện nay, việc điều trị chứng Insomia thường sử dụng các loại thuốc có tác dụng “bắt chước” các hiệu ứng của GABA trong não. Tuy nhiên, việc phát hiện gene Wake đã chứng tỏ rằng hiệu quả của việc chữa trị này bị hạn chế nếu các neurons LNvs này không đủ “nhạy” với các tín hiệu GABA. Do đó, việc tập trung vào gene Wake và protein Wake tương ứng sẽ giúp cải thiện tốt hơn phương pháp điều trị chứng rối loạn giấc ngủ, như Insomia ở người.
Kết luận
Giải Nobel Y học 2017 đã giúp chúng ta nhìn lại một chặng đường dài nghiên cứu cùng với những thành tựu nổi bật nhất về ĐHSH: (1) hoạt động theo cơ chế tự duy trì (self-sustained nature); (2) chu kỳ hoạt động gần 24 giờ; (3) có khả năng đồng bộ với môi trường bên ngoài; (4) có mặt trong hầu hết các quá trình sinh học và cơ thể sống; (5) được tạo ra ở cấp độ phân tử.
Các thành tựu trên đã và đang làm tiền đề cho các nhà khoa học nghiên cứu chuyên sâu hơn nữa về ĐHSH, giúp giải thích, ngăn ngừa và chữa trị các vấn đề sức khoẻ liên quan đến rối loạn ĐHSH: các rối loạn hoạt động cơ thể do sự lệch múi giờ, rối loạn giấc ngủ, các bệnh cấp tính và mãn tính...Việc nghiên cứu và sử dụng các loại thuốc cũng sẽ được điều chỉnh theo đúng với chu kỳ sinh lý của cơ thể để nhận được hiệu quả tốt nhất.
REFERENCES
1. Panda S, Hogenesch JB, Kay SA (2002) Circadian rhythms from flies to human. Nature 417(6886):329–335.
2. Collins B, Blau J (2007) Even a stopped clock tells the right time twice a day: circadian timekeeping in Drosophila. Pflüg Arch - Eur J Physiol 454(5):857–867.
3. Fu M, et al. (2015) Does Circadian Disruption Play a Role in the Metabolic–Hormonal Link to Delayed Lactogenesis II? Front Nutr 2. doi:10.3389/fnut.2015.00004.
4. Davis S, Mirick DK, Stevens RG (2001) Night Shift Work, Light at Night, and Risk of Breast Cancer. JNCI J Natl Cancer Inst 93(20):1557–1562.
5. Hansen J (2001) Increased Breast Cancer Risk among Women Who Work Predominantly at Night. Epidemiology 12(1):74–77.
6. Turek FW, et al. (2005) Obesity and Metabolic Syndrome in Circadian Clock Mutant Mice. Science 308(5724):1043–1045.
7. Lewy AJ, Lefler BJ, Emens JS, Bauer VK (2006) The circadian basis of winter depression. Proc Natl Acad Sci 103(19):7414–7419.
8. Konopka RJ, Benzer S (1971) Clock Mutants of Drosophila melanogaster. Proc Natl Acad Sci 68(9):2112–2116.
9. Zehring WA, et al. (1984) P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic drosophila melanogaster. Cell 39(2, Part 1):369–376.
10. Hardin PE, Hall JC, Rosbash M (1990) Feedback of the Drosophila period gene product on circadian cycling of its messenger RNA levels. Nature 343(6258):536–540.
11. Bargiello TA, Jackson FR, Young MW (1984) Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature 312(5996):752–754.
12. Siwicki KK, Eastman C, Petersen G, Rosbash M, Hall JC (1988) Antibodies to the period gene product of drosophila reveal diverse tissue distribution and rhythmic changes in the visual system. Neuron 1(2):141–150.
13. Hardin PE (2000) From biological clock to biological rhythms. Genome Biol 1:reviews1023.
14. Takeda N, Maemura K (2010) Cardiovascular disease, chronopharmacotherapy, and the molecular clock. Adv Drug Deliv Rev 62(9):956–966.
15. Koh K, Zheng X, Sehgal A (2006) JETLAG Resets the Drosophila Circadian Clock by Promoting Light-Induced Degradation of TIMELESS. Science 312(5781):1809–1812.
16. Liu S, et al. (2014) WIDE AWAKE Mediates the Circadian Timing of Sleep Onset. Neuron 82(1):151–166.


