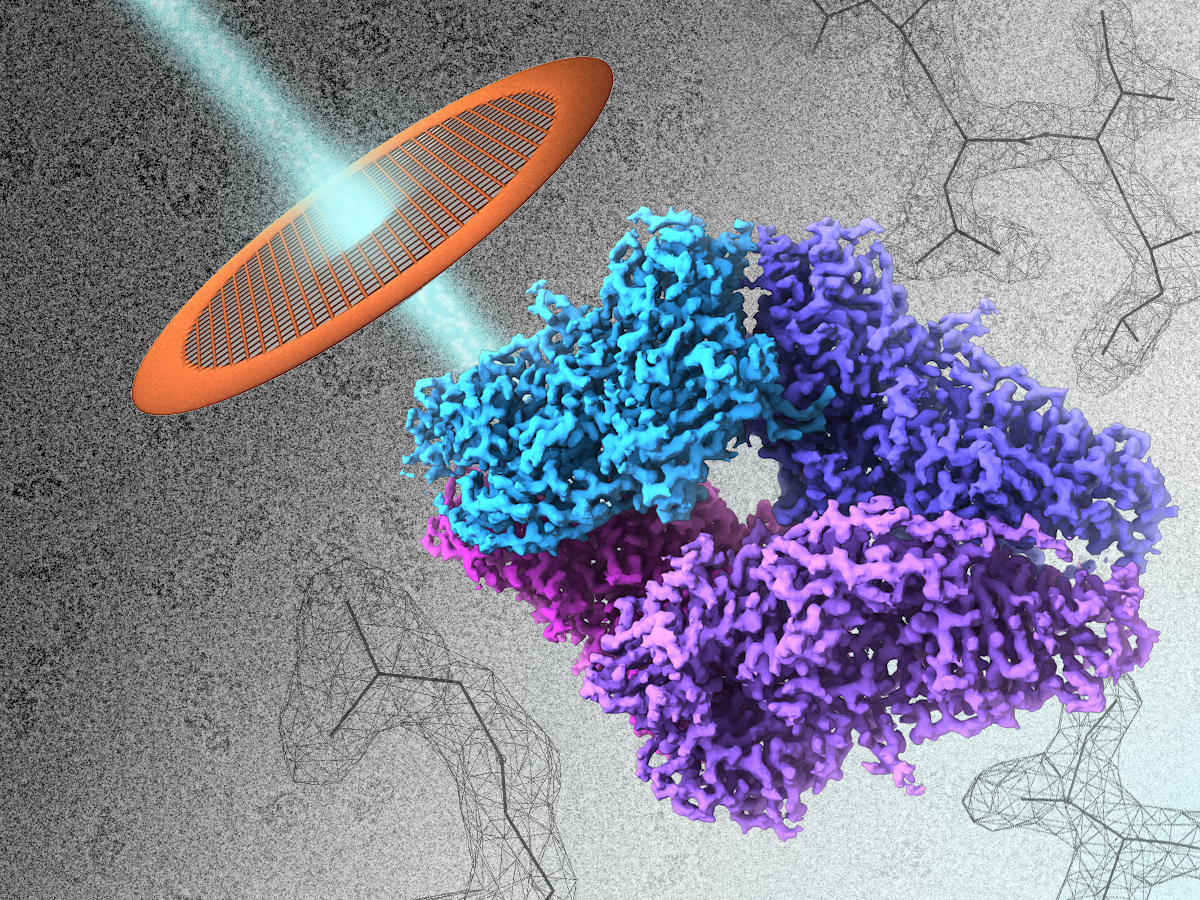
Giải Nobel Hóa học năm 2017 vinh danh nghiên cứu về cryo-electron microscopy (tạm dịch: phương pháp đông lạnh mẫu thử dùng trong kính hiển vi điện tử). Giải thưởng được chia đều cho ba nhà khoa học độc lập: Jacques Dubochet (người Thụy Sỹ, công tác tại Đại học Lausanne, Lausanne, Thụy Sỹ), Joachim Frank (người Đức, làm việc tại Đại học Columbia, New York, Mỹ) và Richard Henderson (người Scotland, công tác tại MRC Laboratory of Molecular Biology, Cambridge, Anh). Phương pháp này cho phép con người lần đầu tiên nhìn (theo đúng nghĩa đen, bằng mắt thường) các phân tử sinh học, chẳng hạn như protein, một cách tự nhiên và đúng bản chất của nó nhất [1].
Những vật chất cơ bản nhất được hình thành cách đây hơn 13 tỷ năm, và đã có vô số hợp chất phức tạp được tạo nên từ chúng. Bàn ghế, nhà cửa, đường sá, thậm chí chính bản thân con người, là những ví dụ. Con người, bằng sự tò mò và sáng tạo vô hạn của mình, đã khám phá được vũ trụ, đi tới cung trăng, phát triển khoa học hạt nhân. Nhưng có một ước mơ chúng ta vẫn chưa chạm tay tới, ước mơ về điều khiển nguyên tử. Bạn có tin rằng giấc mơ về thuật giả kim (phương pháp biến mọi thứ thành vàng) sẽ trở thành sự thật trong tương lai? Rất có thể. Nếu chúng ta nắm được chìa khóa để điều khiển nguyên tử, sắp xếp lại cấu trúc của chúng, thì biến chì thành vàng chỉ là một cách sắp xếp lại số electron, proton, và neutron mà thôi. Giải Nobel năm nay chính là chiếc chìa khóa đó, hay ít ra là một phần của nó.
Thông thường, để nhìn thấy những vật rất nhỏ, cỡ vài micron (như vi khuẩn, tế bào chẳng hạn), chúng ta phải cần sự trợ giúp của kính hiển vi (light microscope). Tuy nhiên, với những cấu trúc siêu nhỏ, cỡ vài chục nano-mét, độ phân giải (resolution) của kính hiển vi thông thường không đủ lớn để mắt người có thể quan sát được. Vì vậy, kính hiển vi điện tử (electron microscope, EM) được ra đời (hình 1).
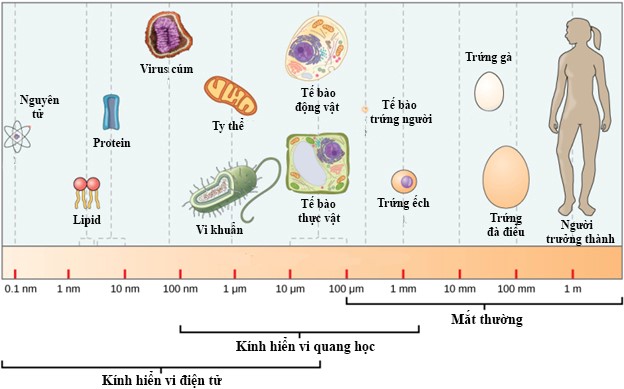
Hình 1: Kích thước một số vật thể và giới hạn quan sát chúng.
Chỉnh sửa từ http://www.hcrowder.com/cells.html
Theo lý thuyết lưỡng tính sóng hạt (wave-particle duality) được đề xuất bởi Louis de Broglie, dựa vào tiền đề trước đó của Einstein, thì mọi vật chất đều mang hai tính chất “sóng” (biểu hiện bởi bước sóng, wavelength) và “hạt” (biểu hiện bởi động năng, momentum) [2]. Bản chất “sóng” càng lớn, tức bước sóng càng dài, thì bản chất “hạt” càng nhỏ, như ánh sáng nhìn thấy hay tia hồng ngoại; và ngược lại, như electron. Electron có bước sóng nhỏ hơn ánh sáng thông thường tới khoảng 100000 lần, và do đó, năng lượng cùng khả năng tương tác với vật chất lớn hơn một số lần tương tự. Điều đó làm cho EM có độ phân giải lên tới vài nano-mét, thậm chí pico-mét [3]. Hai loại EM phổ biến trong giới khoa học là SEM (Scanning EM) và TEM (Transmission EM). Nguyên tắc chung của cả hai là chiếu một tia electron tới mẫu thử, dựa vào sự tương tác giữa electron và mẫu thử mà cấu trúc mẫu thử được tái lập. Tuy nhiên, TEM có độ phân giải lớn hơn SEM và thường được sử dụng trong phân tích các mẫu sinh học, như virus và protein. Thú vị là ứng dụng TEM được trao giải Nobel năm 1986, thì 30 năm sau, nó lại được một lần nữa vinh danh, với một kỹ thuật hiện đại hơn [4].
TEM có thể được xem là phương pháp hiển vi có độ phân giải tốt nhất hiện nay, theo lý thuyết có thể nhìn thấy tận nguyên tử. Tuy nhiên, TEM vẫn có nhược điểm: (1) năng lượng tia chiếu electron quá lớn, ảnh hưởng đến mẫu sinh học (chẳng hạn như biến tính protein), (2) mẫu thử phải được đặt trong môi trường chân không, dẫn tới việc mẫu bị “khô” và cấu trúc sinh học không còn tự nhiên [5]. Để giải quyết vấn đề này, Henderson đã dùng dung dịch glucose để giữ ẩm mẫu thử, đồng thời giảm cường độ dòng electron để tránh phá hủy nó. Điều này lại dẫn tới một vấn đề khác, độ phân giải bị giảm rõ rệt. Ông xử lý bằng cách chụp nhiều hình ảnh ở các vị trí và thời điểm khác nhau, sau đó “ghép” lại thành một cấu trúc 3D hoàn chỉnh, tương tự như phương pháp chụp cắt lớp điện toán (CT) mà chúng ta sử dụng trong bệnh viện [5]. Dù vậy, cấu trúc protein ông quan sát, bacteriorhodopsin, có cấu trúc khá “trật tự”, tức các đơn phân được sắp xếp một cách “nề nếp”. Làm cách nào để nhìn được những mọi phân tử protein, bất kể cấu trúc chúng ra sao? Frank giải quyết một phần vấn đề bằng thuật toán đại số. Bằng cách chia nhóm những hình dạng liên quan, và “trung bình hóa” chúng, ông có thể làm tăng độ phân giải của các cấu trúc protein phức tạp. Phần còn lại của vấn đề được Dubochet giải quyết bằng kỹ thuật đông lạnh (cryo-). Trên thực tế, mẫu thử rắn cho độ phân giải cao hơn nhiều so với mẫu thử lỏng, đơn giản vì loại bỏ được những tín hiệu nhiễu từ phân tử nước. Nhưng nếu bốc hết hơi nước, protein sẽ không còn ở trạng thái tự nhiên nữa. Rất thông minh, Dubochet đã đông rắn mẫu thử protein bằng nitrogen lỏng, ở nhiệt độ -196oC (gần bằng không độ tuyệt đối, -273.15oC, nhiệt độ lý thuyết có thể dừng mọi chuyển động của vật chất). Do thời gian hóa rắn nhanh nên các tinh thể nước đá không kịp hình thành, dẫn đến việc bảo toàn tình trạng protein. Và độ phân giải mẫu thử được tăng lên đáng kể, khoảng 0.5 nm [5].
Qua hàng chục năm phát triển, cryo-EM, với độ phân giải ngày càng được cải tiến (hình 2), đã, đang và sẽ là công cụ đắc lực của nhân loại trong quá trình đi về nguồn cội lẫn tiến tới tương lai. Về lý thuyết, kỹ thuật này có thể giải cấu trúc của tất cả các loại protein, kể cả một số virus như virus Zika. Hình dạng thực sự của protein, một trong bốn loại đại phân tử cấu thành sự sống, đã, đang, và sẽ được khám phá.
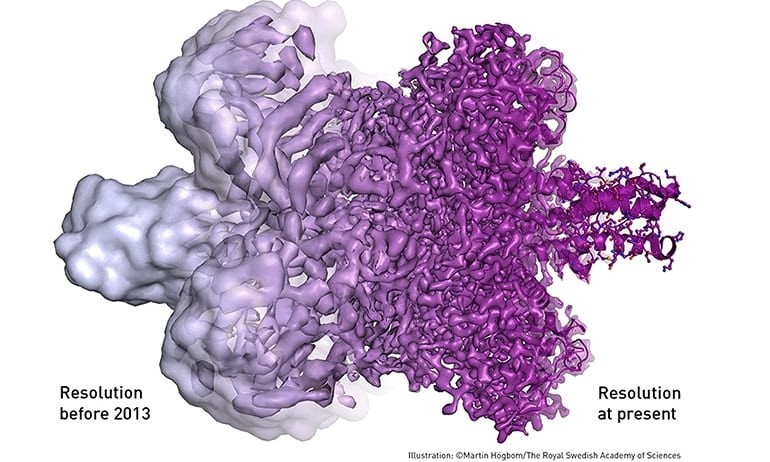
Hình 2: Độ phân giải của phân tử protein với phương pháp cryo-EM.
(Trái) trước năm 2013, (phải) hiện nay (năm 2017). Nguồn: [6]
Thay lời kết, tác giả muốn nhấn mạnh một điều về giải Nobel này, cũng như những phát minh khác. Không cao siêu triết lý khó hiểu, mọi phát kiến vĩ đại đều đến từ trí tò mò vô tận và nỗ lực không ngừng nghỉ của con người. Nếu ngày đó không ai tò mò về một thế giới nhỏ bé nằm sâu bên trong từng tế bào chúng ta, hẳn kính hiển vi điện tử đã không tồn tại. Và 30 năm sau, nếu không có những nỗ lực giải quyết khó khăn trong hành trình đi tìm sự thật, chắc rằng tôi đã không có bài viết này.
Tác giả: Phạm Duy Toàn – Đại học Naresuan, Thái Lan
Tài liệu tham khảo:
1. “The Nobel Prize in Chemistry 2017”. Nobelprize.org. Nobel Media AB. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/
2. Menzel DH (ed.) (1960) Fundamental Formulas of Physics, Vol. 1, p. 153.
3. Erni R, Rossell MD, Kisielowski C, Dahmen U (2009) Atomic-resolution imaging with a sub-50-pm electron probe. Phys Rev Lett 102(9):096101.
4. "The Nobel Prize in Physics 1986 - Perspectives". Nobelprize.org. Nobel Media AB. http://www.nobelprize.org/nobel_prizes/physics/laureates/1986/perspectives.html
5. Stokstad E, Service RF (2017) A cold, clear view of life wins chemistry Nobel. http://www.sciencemag.org/news/2017/10/cold-clear-view-life-wins-chemistry-nobel.
6. The Guardian (2017) Nobel prize in chemistry awarded for method to visualise biomolecules. https://www.theguardian.com/science/2017/oct/04/nobel-prize-in-chemistry-awarded-for-method-to-visualise-biomolecules.
Ảnh bìa: Nguồn từ https://www.biotechniques.com/news/The-Climb-of-Cryo-EM/biotechniques-359786.html


